检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2019年3月13日,北京大学高宁课题组和清华大学陈柱成课题组合作在Nat. Struct. Mol. Biol杂志发表题为 “ISWI-核小体复合物的结构揭示出保守的染色质重塑机制” (Structures of the ISWI-nucleosome complex reveal a conserved mechanism of chromatin remodeling) 的研究论文。
ISWI驱动核小体在基因组DNA上滑动以重塑染色质结构,参与调控基因转录、异染色质形成、X-染色体失活及其它重要的核酸活动。然而,此前并没有高分辨的ISWI-核小体复合物的三维结构,ISWI的工作机理仍有赖于进一步的研究和阐释。
本工作采用冷冻电镜技术解析了ADP-BeFx和ADP两种状态下染色质重塑蛋白ISWI与其底物核小体结合的高分辨结构(图a-b)。通过与核小体的相互作用,ISWI催化核心core2亚基发生148°的旋转,从而解除ISWI蛋白本身的自抑制,这一结构发现揭示了核小体激活ISWI的机理(图c)。进一步对比分析ADP-BeFx和ADP状态下ISWI-核小体复合物的结构差异,作者发现ATP水解后,核小体SHL2处DNA产生了1 bp隆起(核小体DNA的分辨率达到3.3 Å)。上述两个高分辨结构展示出染色质重塑过程中“DNA波”的具体存在形式(图d),为理解ISWI发挥重塑功能的分子机理提供了结构生物学基础。ISWI的这一功能模式与陈柱成组同期发表的关于Snf2的工作机制高度相似 (Li et al., Nature 2019,https://www.nature.com/articles/s41586-019-1029-2),从而证明染色质重塑因子发挥功能具有一定的保守性。
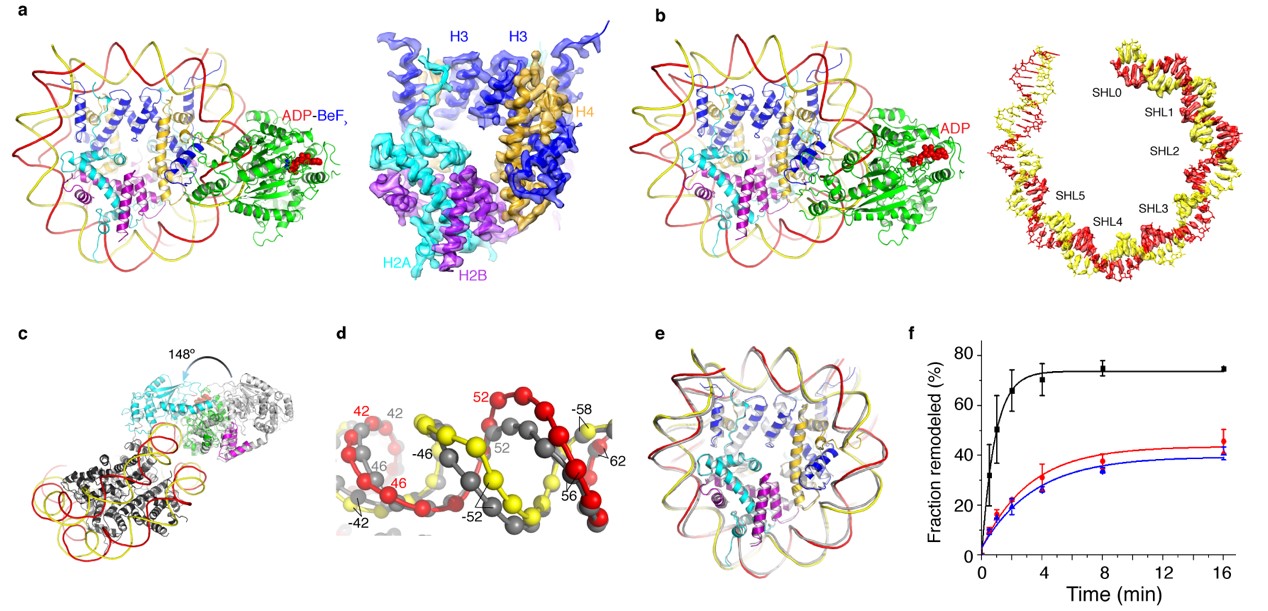
图 1 ISWI-核小体复合物在不同功能状态下的高分辨结构
(a) ADP-BeFx状态; (b) ADP 状态; (c) ISWI被核小体激活的机理;(d) ISWI(ADP)引起的DNA形变;(e) ISWI作用下,组蛋白核心保持正常结构;(f) 组蛋白形变不是ISWI介导的染色质重塑的必须条件。
值得一提的是,2016年有文献报道ISWI结合核小体之后诱使组蛋白核心发生了扭曲,这种形变为ISWI发挥染色质重塑功能所必需,此假说引起了领域内的广泛关注。但高分辨的结构表明核小体组蛋白并未产生形变,本工作亦进一步通过更温和、彻底的蛋白交联实验证明ISWI发挥染色质重塑过程不依赖于组蛋白变形(图f)。
清华大学陈柱成研究员和北京大学高宁教授为本文的共同通讯作者,清华大学永利官网2014级博士生严丽娟(陈柱成组)和2014级PTN博士生吴昊(高宁组)为论文的共同一作。北京大学电镜实验室李雪梅博士参与了数据的收集工作。该研究得到国家重大研发计划、国家自然科学基金委、北京市高精尖结构生物学中心和生命联合中心项目的经费支持,以及北京大学电镜实验室(冷冻电镜平台)、北京大学高性能计算中心、清华大学电镜平台和计算平台的工作支持。