检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox

封面设计源于中国古代象征生殖的图腾——玄武,寓意哺乳动物通过有性生殖(蛇与龟)来维持完整的生命周期(圆环),而中心处的生殖细胞(红色)则在遗传信息的世代沿袭中起着非常关键的作用
2015年6月4日,国际知名学术期刊CELL以封面文章的形式发表了永利官网生物动态光学成像中心汤富酬研究组和北京大学第三医院乔杰研究组的最新研究成果——人类原始生殖细胞的转录组和DNA甲基化组概观(The Transcriptome and DNA Methylome Landscapes of Human Primordial Germ Cells)。该项工作系统、深入地研究了人类多个发育阶段原始生殖细胞(PGC)的转录组和DNA甲基化组,发现人类原始生殖细胞不同于小鼠原始生殖细胞的关键独特特征。
人类原始生殖细胞产生于胚胎发育的早期,是发育为成熟的精子和卵细胞的前体细胞,精卵结合后会发育成新的个体、并将遗传物质传递给下一代以维持种族的延续。因此,对人类早期胚胎以及原始生殖细胞的发育过程进行深入的研究对于理解人类胚胎发育特征以及对于反复流产、胚胎停育、不孕不育等疾病发病机制的认识具有重要意义。基因组DNA甲基化作为一种重要的表观遗传修饰方式,是调控细胞分化发育过程中基因表达的主要机制之一,它并不改变基因序列,但是可以遗传给后代,容易受外界环境的影响而发生改变,在胚胎发育、干细胞分化、癌症发生等方面发挥着重要的作用。过去人们以小鼠作为模式动物进行研究,发现了复杂基因表达调控网络和大规模DNA甲基化重编程对于早期胚胎以及原始生殖细胞发育的调控规律。但是由于物种间的差异,这些以小鼠为模型得出的调控规律是否适用于人类早期胚胎和原始生殖细胞的发育过程并不清楚。人类胚胎在发育过程中有两轮大规模的DNA甲基化组重编程发生。第一轮发生在受精后的植入前胚胎中,第二轮发生在植入后的生殖细胞中。
北京大学研究团队利用自己团队在国际上率先发展的高灵敏度的DNA甲基化组高通量测序技术,首先对人类植入前胚胎的DNA甲基化图谱进行了单碱基分辨率的、全基因组测序分析,发现人类精卵结合后,早期胚胎的基因组DNA发生大规模的去甲基化,甲基化程度从精子中的86%(中位数)降低到囊胚期胚胎中的43%,而在这一过程中印记基因控制区域的DNA甲基化得以精确的维持。在植入后的胚胎中,基因组DNA被大规模重新甲基化,DNA甲基化水平增加到92%。该项研究还发现了DNA甲基化组重编程对于基因表达网络的关键调控特征。相关的研究成果发表在2014年7月的Nature上。该项研究为人们提供了一个深入分析人类早期胚胎发育过程中基因表达网络表观遗传调控的坐标系统。
在此基础上,该研究团队对人类胚胎中第二轮DNA甲基化组重编程过程及其对基因表达网络的调控关系进行了深入、全面的分析。在正常情况下,一个植入后胚胎内大部分组织器官的基因组DNA加上甲基化标记后就基本维持稳定、不再擦去,而含有要传递给后代遗传信息的原始生殖细胞则要经历大规模的DNA甲基化擦除和重建的过程。该团队利用精细的流式细胞分选技术对于不同发育阶段以及不同性别的人类原始生殖细胞进行了分选、收集,再结合单细胞转录组高通量测序、微量细胞DNA甲基化组高通量测序、微量细胞DNA羟甲基化组高通量测序等技术、以及细胞免疫荧光技术,对人类原始生殖细胞的转录组、DNA甲基化组、以及组蛋白共价修饰等关键特征进行了深入的分析。
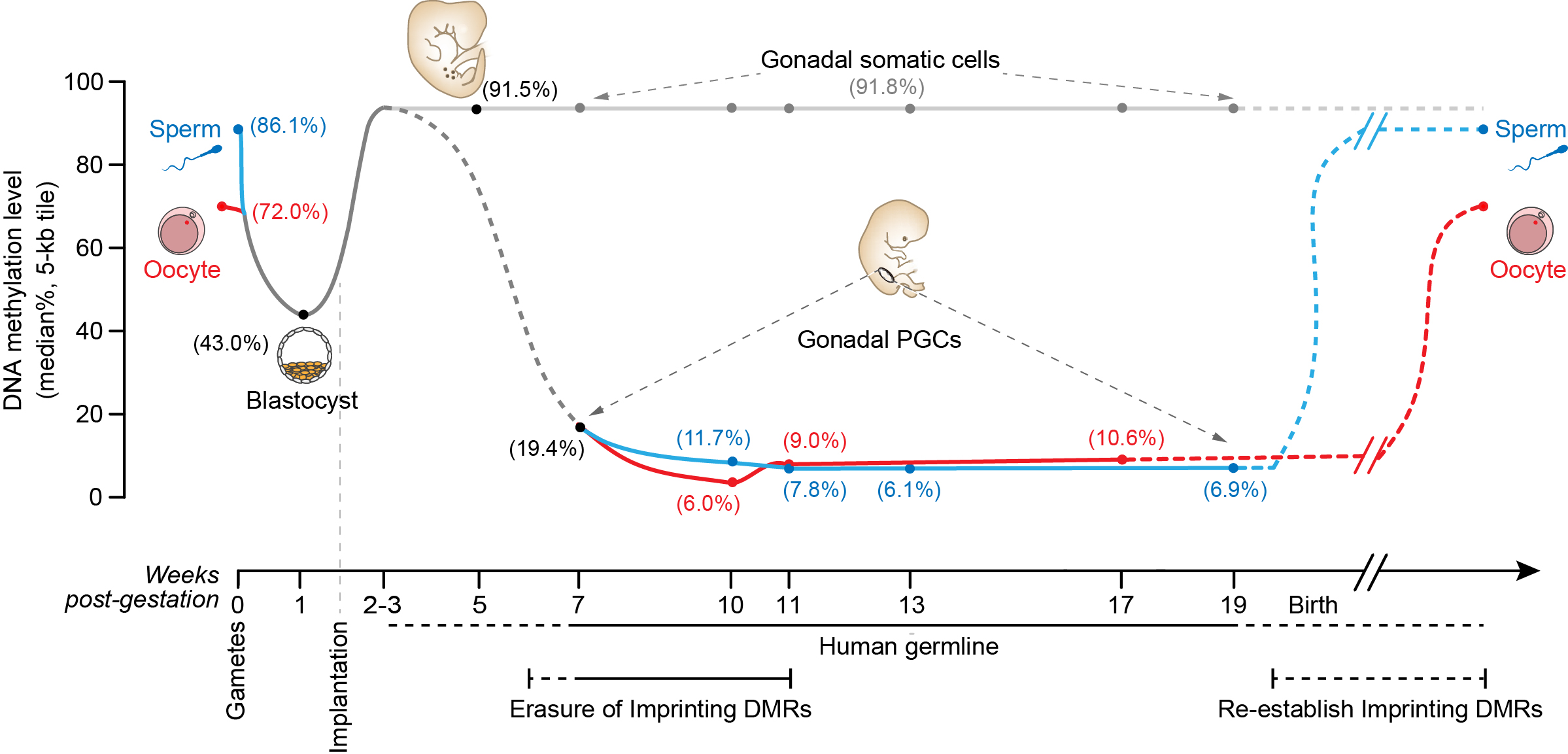
人类生殖细胞系(精子、卵细胞及原始生殖细胞)、囊胚以及着床后胚胎体细胞的DNA甲基化水平示意图
该项研究发现,与小鼠原始生殖细胞类似,处于发育早期阶段的人类原始生殖细胞也会表达一系列与干细胞多能性相关的基因(例如OCT4、NANOG和REX1等),印证了用小鼠作为模式动物研究原始生殖细胞发育过程的重要性。另外一方面,与小鼠不同的是,人类原始生殖细胞并不表达关键的转录因子基因SOX2,取而代之的是表达另外两个SOX家族基因——SOX15和SOX17。同时,人类原始生殖细胞还表达一系列与生殖细胞发育相关的基因(例如KIT、TNAP、AP2γ和NANOS3等)。与早期处于有丝分裂阶段的细胞相比,进入减数分裂阶段的人类原始生殖细胞其转录组发生明显改变,同时细胞之间的异质性也大大增强,提示原始生殖细胞在进入减数分裂停滞期时同一个胚胎的不同生殖细胞处于显著不同的发育状态。其次,在人类植入后雌性胚胎中,每个细胞的两条X染色体中的一条会随机失活,以保持两性的X染色体剂量相同(两性都保持每个细胞中只有一条活跃转录的X染色体)。而在人类雌性胚胎的生殖细胞中失活的那条X染色体会被重新激活,该团队发现这一过程在发育第4周的雌性原始生殖细胞中就已经完成了,明显早于小鼠原始生殖细胞中X染色体的重新激活。第三,人类原始生殖细胞在发育过程中会经历大规模的DNA甲基化擦除,并且在发育到第10-11周时,DNA甲基化水平降低13倍达到了最低点,从植入后早期胚胎中的92%降低到此时的7%左右。这是人类所有已知类型的正常细胞中DNA甲基化程度最低的细胞类型,说明原始生殖细胞的DNA甲基化组具有鲜明的独特性。第四,虽然人类原始生殖细胞基因组中绝大部分区域的DNA甲基化被完全擦除,但在一些重复序列原件上仍然残留大量DNA甲基化,尤其是微卫星序列ALR(37%)以及一些进化上比较年轻的重复原件,如L1(23%)、Alu(12%)和ERVK(30%)等,为人类隔代遗传现象的表观遗传学分析提供了有用的线索。最后,在如此大规模的DNA甲基化组重编程过程中,转录组水平的基因表达网络保持了高度稳定,组成性异染色质也保持稳定,提示表观遗传调控的其他关键组分、特别是组蛋白的各种共价修饰在这一过程中可能起了关键作用。
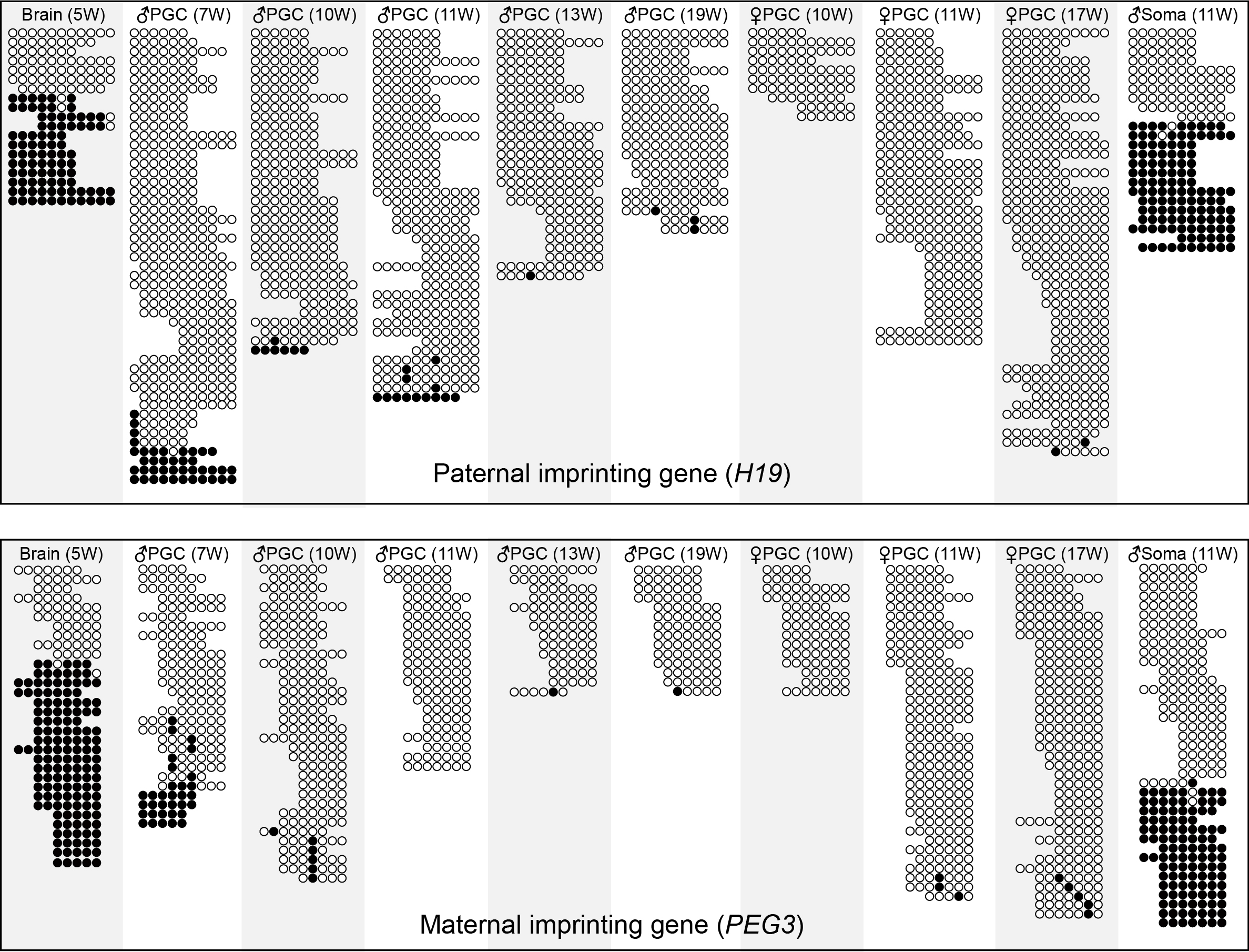
父本印迹基因H19和母本印迹基因PEG3在各个发育阶段的原始生殖细胞以及体细胞中的DNA甲基化。其中每一行连锁的圆圈代表全基因组DNA甲基化测序结果中一条读段上的CpG位点,白色圆圈代表未甲基化的CpG位点,黑色圆圈代表甲基化的CpG位点
该项工作首次分别在单细胞以及单碱基分辨率对人类原始生殖细胞的转录调控网络和DNA甲基化重编程过程进行了深入、系统的分析,加深了对人类原始生殖细胞的发育以及表观遗传重编程过程的认识。为人类生殖细胞的表观遗传重编程、早期胚胎全能性的建立、DNA甲基化的隔代遗传、以及胚胎干细胞向精卵定向分化等问题的探究提供了理论基础。对辅助生殖技术的安全性评估、疾病对后代影响的评价、以及临床上生殖细胞发育异常相关疾病的研究具有非常重要的意义。
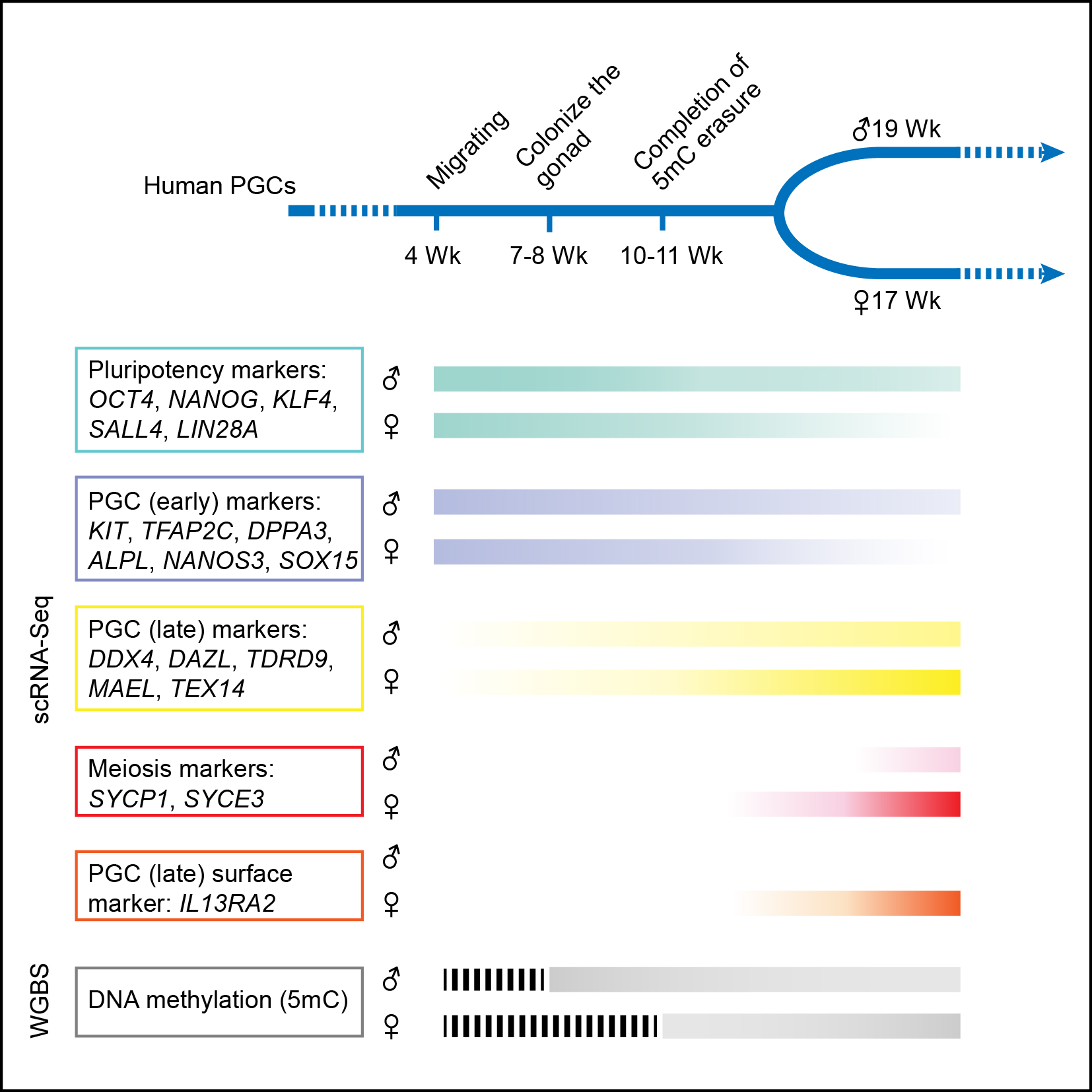
人类原始生殖细胞代表性基因的表达水平以及DNA甲基化随发育时间变化的示意图
北京大学的郭帆博士、闫丽盈博士、博士生郭红山、博士生李琳是这篇论文的并列第一作者。永利官网生物动态光学成像中心的汤富酬研究员和北京大学第三医院的乔杰教授是该论文的共同通讯作者,永利官网生物动态光学成像中心的高毅勤研究组参与了该项研究的关键生物信息学分析工作。该项研究得到了国家自然科学基金、国家重大科学研究计划、北京市科委前沿项目基金、以及北大清华联合中心基金等支持。
Fan Guo*, Liying Yan*, Hongshan Guo*, Lin Li*, Boqiang Hu, Yangyu Zhao, Jun Yong, Yuqiong Hu, Xiaoye Wang, Yuan Wei, Wei Wang, Rong Li, Jie Yan, Xu Zhi, Yan Zhang, Hongyan Jin, Wenxin Zhang, Yu Hou, Ping Zhu, Jingyun Li, Ling Zhang, Sirui Liu, Yixin Ren, Xiaohui Zhu, Lu Wen, Yi Qin Gao, Fuchou Tang & Jie Qiao. The Transcriptome and DNA Methylome Landscapes of Human Primordial Germ Cells. Cell 161, 1437–1452. (2015) (*co-first author)
Hongshan Guo*, Ping Zhu*, Liying Yan*, Rong Li*, Boqiang Hu, Ying Lian, Jie Yan, Xiulian Ren, Shengli Lin, Junsheng Li, Xiaohu Jin, Xiaodan Shi, Ping Liu, Xiaoye Wang, Wei Wang, Yuan Wei, Xianlong Li, Fan Guo, Xinglong Wu, Xiaoying Fan, Jun Yong, Lu Wen, Sunney X. Xie, Fuchou Tang & Jie Qiao. The DNA methylation landscape of human early embryos. Nature 511, 606–610. (2014) (*co-first author)