检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
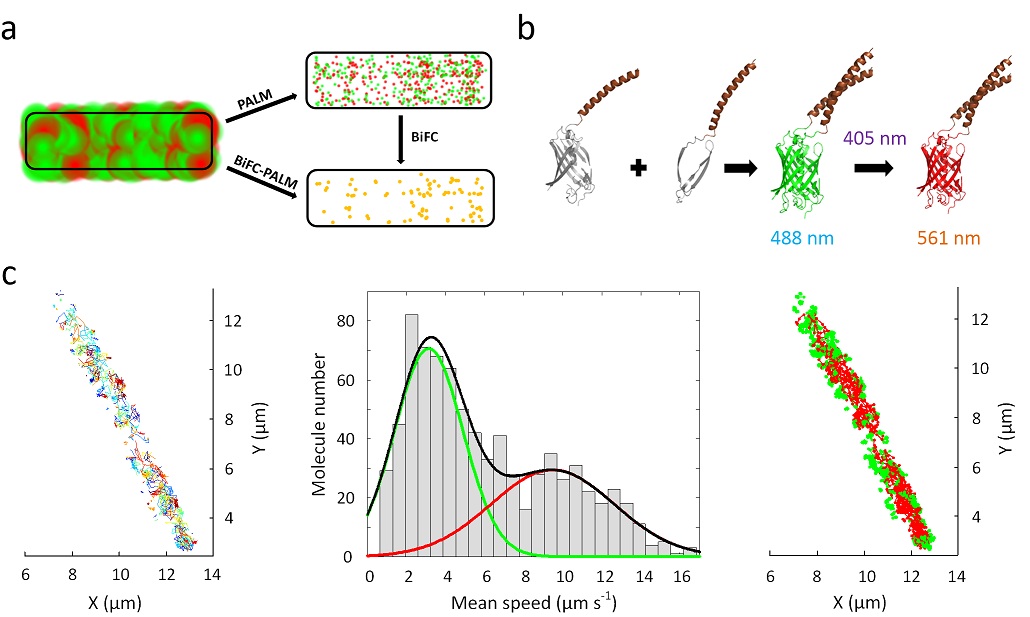
永利官网孙育杰课题组近日在《自然 通讯》在线发表题为“Super-resolution imaging and tracking of protein–protein interactions in sub-diffraction cellular space” 的文章,报道了其最新研发的观测蛋白相互作用的成像技术双分子荧光互补-光激活定位显微术(BiFC-PALM)及其在揭示蛋白-蛋白相互作用在亚衍射细胞空间分布和运动规律方面的应用。
直接观测活细胞内蛋白-蛋白相互作用极其重要但技术方面却非常困难,这主要是由于没有相互作用的蛋白会带来极强的背景干扰。超分辨成像虽然突破了衍射极限,但是双色超分辨成像依然受此干扰的制约而不能准确识别分子间相互作用以及其动态过程的追踪。
该研究团队报道了一种结合双分子荧光互补(BiFC)和光激活定位成像(PALM)的方法。该方法借助由特异的蛋白相互作用互补形成的光转换荧光蛋白mEos 3.2,通过光激活定位成像实现了活细胞内特异的超高分辨蛋白-蛋白相互作用的观察,将空间分辨率由传统荧光成像的200纳米左右推进到了约25纳米,并且实现了单蛋白对的实时追踪并达到了20毫秒的时间分辨率。
该课题组应用此方法研究大肠杆菌内高丰度蛋白细菌骨架蛋白MreB和翻译延伸因子EF-Tu的相互作用并观察到了极为有趣的依赖于亚细胞定位的运动模式。揭示了MreB–EFTu互作在细菌形态维持方面的重要作用。这也是第一次实现在亚衍射极限内观察高密度的蛋白-蛋白相互作用。
该方法无论是在研究蛋白-蛋白相互作用方面还是超分辨成像方面都具有非常好的原创性,并为此方向相关研究提供了极大的便利。
论文的第一作者是永利官网生物动态光学成像中心博士研究生刘振,论文的通讯作者是永利官网生物动态光学成像中心研究员孙育杰。该工作得到了国家自然科学基金的资助。
原文链接