检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
结直肠癌在全球范围内是发病率第三、致死人数第四的恶性肿瘤(Beattie et al., 2005)(Carey, 2017; Church, 2016)。结直肠腺瘤是结直肠癌的癌前病变,根据组织学形态可以分为低级别腺瘤和高级别腺瘤,从低级别腺瘤到腺癌的序列发生需要10年以上时间。因此,深入解析低级别腺瘤向腺癌转化的分子机制对于结直肠癌的预防、早筛和治疗都有重要意义。家族性腺瘤性息肉病(Familial adenomatous polyposis, FAP)约占全部结直肠癌的1%,FAP的遗传与APC抑癌基因密切相关,APC基因的胚系突变启动了大肠癌沿正常粘膜—低级别腺瘤—高级别腺瘤—癌的多阶段多步骤发生模式, 如不及时肠镜下切除息肉或者手术切除相应肠管,息肉癌变率可高达90%以上。FAP患者体内存在大量的起始于同一APC基因突变的处于不同演进阶段的结直肠肿瘤性病变,即同一个体体内同时存在正常上皮、不同级别腺瘤、早期癌、进展期癌等不同病变。同时,这些肿瘤性病变具有相同的遗传背景,面临相同的致癌因素和选择压力(Bodmer et al., 1987; Groden et al., 1991; Kinzler et al., 1991; Nagase and Nakamura, 1993; Rengifo-Cam et al., 2016)。这为研究结直肠腺瘤的癌变过程提供了非常好的研究材料。
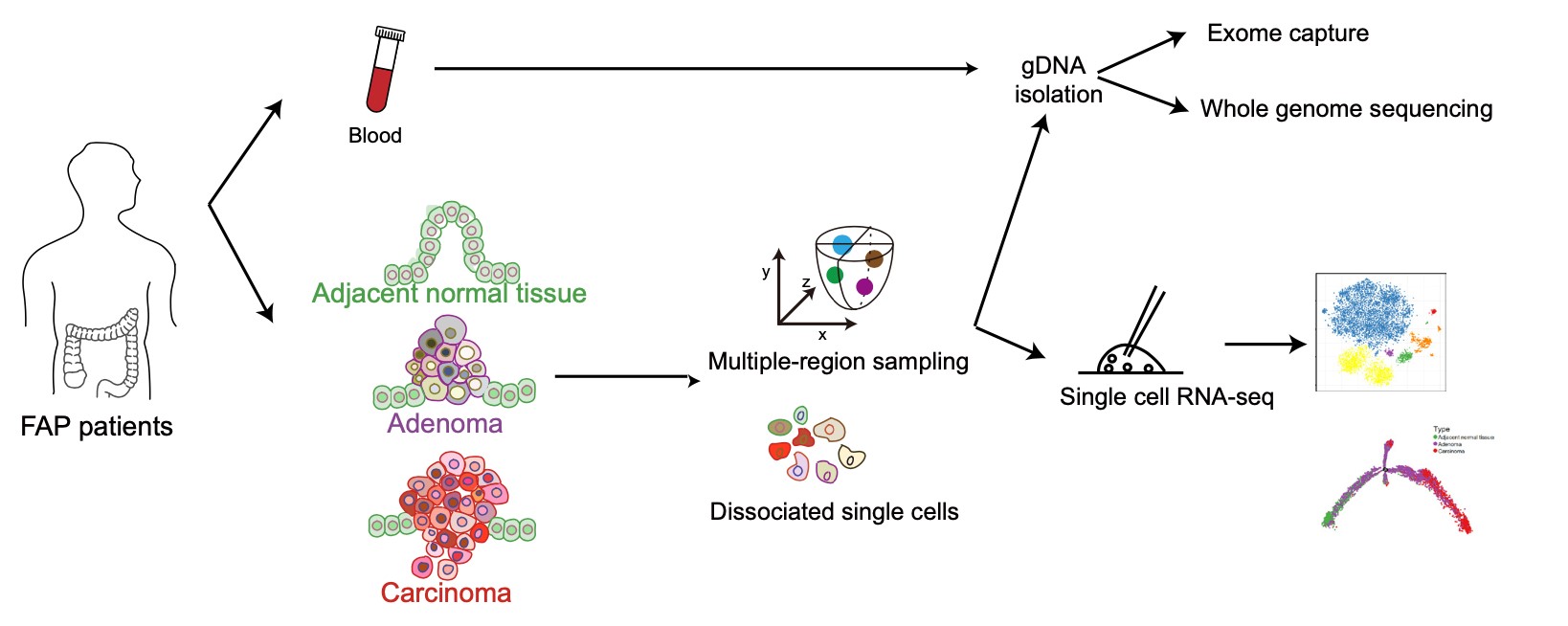
2019年11月19日,北京大学汤富酬课题组与北医三院付卫课题组联合在国际知名学术期刊Gut发表题目为“Genomic and transcriptomic profiling of carcinogenesis in patients with familial adenomatous polyposis”的研究论文。该研究从6例典型的FAP患者和1例非典型的FAP患者(MUTYH相关FAP)手术样品中共获取了56 份样本,包括6份外周血、12份癌旁组织、23份低级别腺瘤组织、5份高级别腺瘤组织以及 10份腺癌组织。并通过全基因组浅测序和全外显子组深测序,深入研究了来自于同一个FAP患者的多个病变组织之间的谱系发生关系以及良性腺瘤向恶性腺癌转变过程中的基因组变异情况。同时,为了研究腺瘤发生及腺瘤向腺癌恶变过程中的转录组动态变化,该研究对来自 6例典型的FAP患者、1例非典型的FAP患者以及 2 例对照散发结直肠癌患者的 8,757 个细胞进行了高精度的单细胞转录组测序。并以这些单细胞转录组数据为基础,重构了腺瘤发生以及腺瘤向腺癌恶化的转录组动态变化过程,系统的阐述了该过程中重要的基因表达变化事件(图1)。
1. 在单个病人的水平上探究了正常上皮向腺瘤以及腺癌发生过程中的基因组变异情况。该研究通过比较来自于同一个患者的不同病变阶段的腺瘤和腺癌组织,发现即使是低级别腺瘤,其体细胞突变的数目相对于癌旁组织已经明显升高。特别是,良性的高级别腺瘤的体细胞突变数目甚至可以比恶性腺癌的体细胞突变数目还高。出现频率最高的潜在体细胞致病突变是抑癌基因APC基因的二次失活突变(同一个细胞中另外一个野生型APC等位基因的失活突变)(69%),此外,不同患者在其他潜在的致病基因的突变谱上表现出了强烈的个体间异质性。
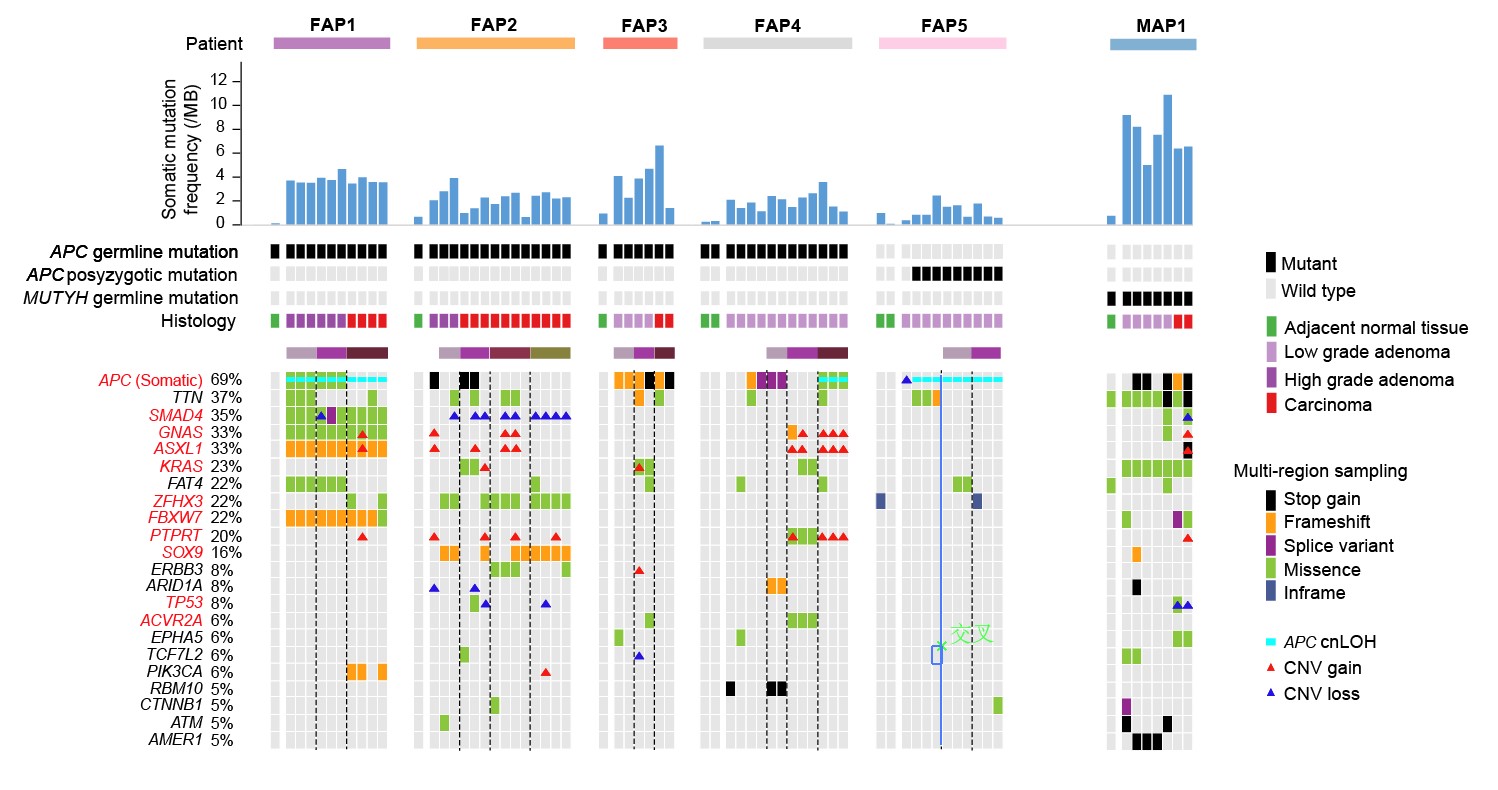
图2. FAP患者中潜在致病基因的突变谱。
2. FAP患者中存在区域癌变现象。该研究通过体细胞突变情况对来自于同一个患者的不同病变组织构建了谱系发生树。在其中2例患者中(FAP1和FAP2),发现物理位置较近的多个原位腺瘤和腺癌起源于同一个病变始祖细胞,这证明了在FAP患者中存在之前在散发结直肠癌研究报道的区域癌变现象(图3)(Baba et al., 2016; Curtius et al., 2017; Slaughter et al., 1953),也就是病变始祖细胞分裂增殖的后代细胞迁移到肠上皮组织的不同部位并进一步进展到腺瘤和腺癌阶段,产生物理上分隔开(但是有共同谱系来源的)的不同肿瘤块。阐明FAP患者中存在区域癌变现象对于进一步理解结直肠多发腺瘤的发生机制和临床治疗具有重要的指导意义。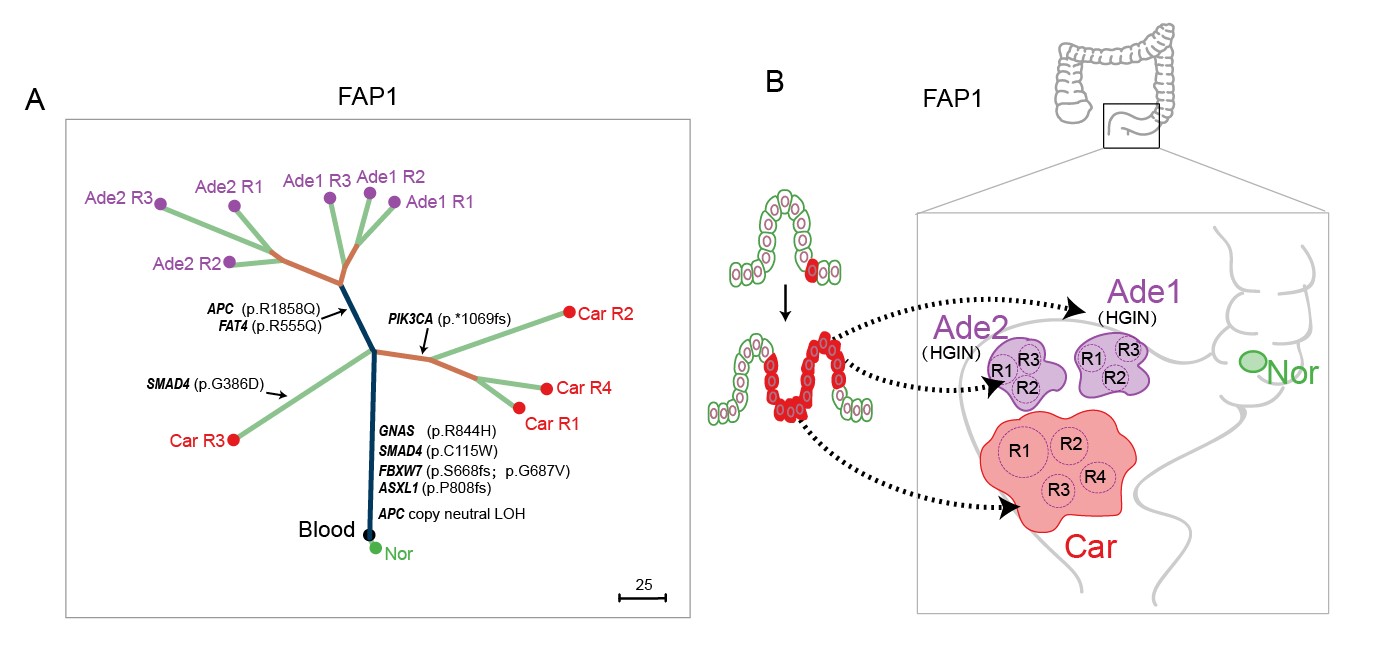
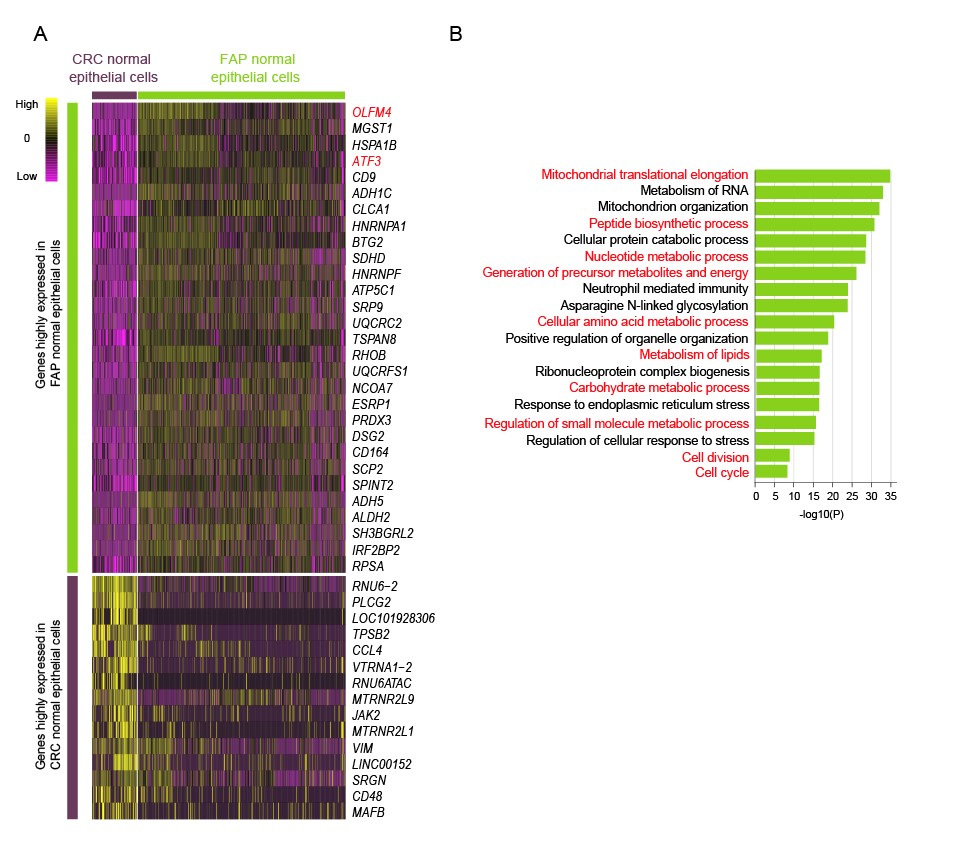
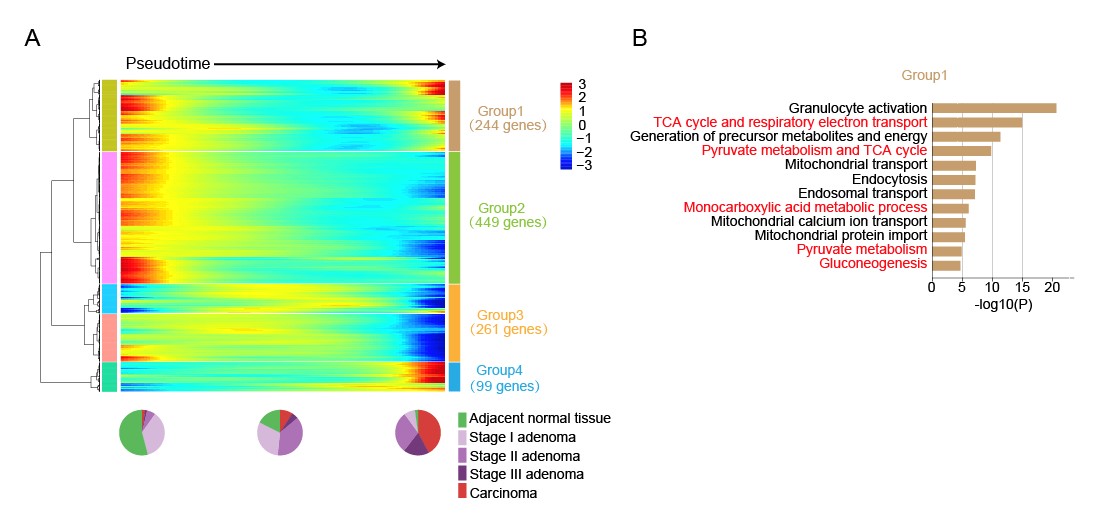
图5. (A)将随拟时间动态变化的基因按照其动态变化趋势聚类。(B)对第一类基因做GO分析。
综上所述,本文以家族性腺瘤性息肉病为模型,在单个患者的水平上深入探究了结直肠癌发生发展过程中的关键分子变化特征,特别是正常上皮向良性腺瘤转化、以及良性腺瘤向恶性腺癌的转化过程中重要的基因组变异事件和转录组的变化特征,为研究结直肠癌发生的早期事件提供了新的线索和思路。
北京大学生物医学前沿创新中心(BIOPIC)李静云博士、汪睿博士、以及北京大学第三医院周鑫博士、博士生王文东为该论文的并列第一作者,北京大学永利官网、北京未来基因诊断高精尖创新中心汤富酬教授和北京大学第三医院付卫教授为该论文的共同通讯作者。该课题得到了北京大学生命科学仪器中心(成像平台)和北京大学高精尖中心高通量测序平台的协助与支持。
原文链接:
https://gut.bmj.com/content/early/2019/11/18/gutjnl-2019-319438
参考文献:
ADDIN Mendeley Bibliography CSL_BIBLIOGRAPHY Baba, Y., Ishimoto, T., Kurashige, J., Iwatsuki, M., Sakamoto, Y., Yoshida, N., Watanabe, M., and Baba, H. (2016). Epigenetic field cancerization in gastrointestinal cancers. Cancer Lett. 375, 360–366.
Beattie, J., Crozier, A., and Duthie, G. (2005). Potential Health Benefits of Berries. Curr. Nutr. Food Sci. 1, 71–86.
Bodmer, W.F., BaiJey, C.J., Bodmer, J., Bussey, H.J.R., Ellis, A., Gormanll, P., LucibelIo, F.C., Murday, V.A., Rider, S.H., Scambler, P., et al. (1987). Localization of the gene for familial adenomatous polyposis on chromosome 5. Nature 328, 614–616.
Carey, F. (2017). Pathology of colorectal neoplasia. Surg. (United Kingdom) 35, 126–131.
Church, J. (2016). Molecular genetics of colorectal cancer. Semin. Colon Rectal Surg. 27, 172–175.
Curtius, K., Wright, N.A., and Graham, T.A. (2017). An evolutionary perspective on field cancerization. Nat. Rev. Cancer 18, 19–32.
Groden, J., Thliveris, A., Samowitz, W., Carlson, M., Gelbert, L., Albertsen, H., Joslyn, G., Stevens, J., Spirio, L., Robertson, M., et al. (1991). Identification and characterization of the familial adenomatous polyposis coli gene. Cell 66, 589–600.
Kinzler, K.W., Nilbert, M.C., Su, L.K., Vogelstein, B., Bryan, T.M., Levy, D.B., Smith, K.J., Preisinger, A.C., Hedge, P., McKechnie, D., et al. (1991). Identification of FAP locus genes from chromosome 5q21. Science (80-. ). 253, 661–665.
Nagase, H., and Nakamura, Y. (1993). Mutations of the APC adenomatous polyposis coli) gene. Hum. Mutat. 2, 425–434.
Rengifo-Cam, W., Jasperson, K.W., Burt, R.W., and Jewel Samadder, N. (2016). Familial adenomatous polyposis. Intest. Polyposis Syndr. Diagnosis Manag. 101, 173–195.
Slaughter, D.P., Southwick, H.W., and Smejkal, W. (1953). “Field cancerization” in oral stratified squamous epithelium. Clinical implications of multicentric origin. Cancer 6, 963–968.
Weinberg, R.A. (2014). The biology of cancer second edition (New York: Garland Science, Taylor & Francis Group, LLC).